
huHSC-NCG-X
c-kit原癌基因编码蛋白是一种祖/干细胞生长因子受体(SCFR),又称为CD117。正常表达于造血干/祖细胞,在急性淋巴细胞白血病中极少或不表达。在造血祖细胞由骨髓迁移至血浆的信号通路中c-kit蛋白起重要作用。c-kit突变可能与多种类型的癌症有关。W41是c-kit蛋白的第831位Val至Met的点突变。该点突变的小鼠自发贫血,其造血干细胞功能受到抑制。
集萃药康自主研发NCG-X品系,该品系在HSC的重建过程中可免辐照,且huHSC-NCG-X可在小鼠骨髓中重建红系细胞,可用于研究地中海贫血。
应用领域
1. 人类免疫系统发育研究
2. 人类感染病研究
3. 抗肿瘤研究
验证数据
1. mRNA检测
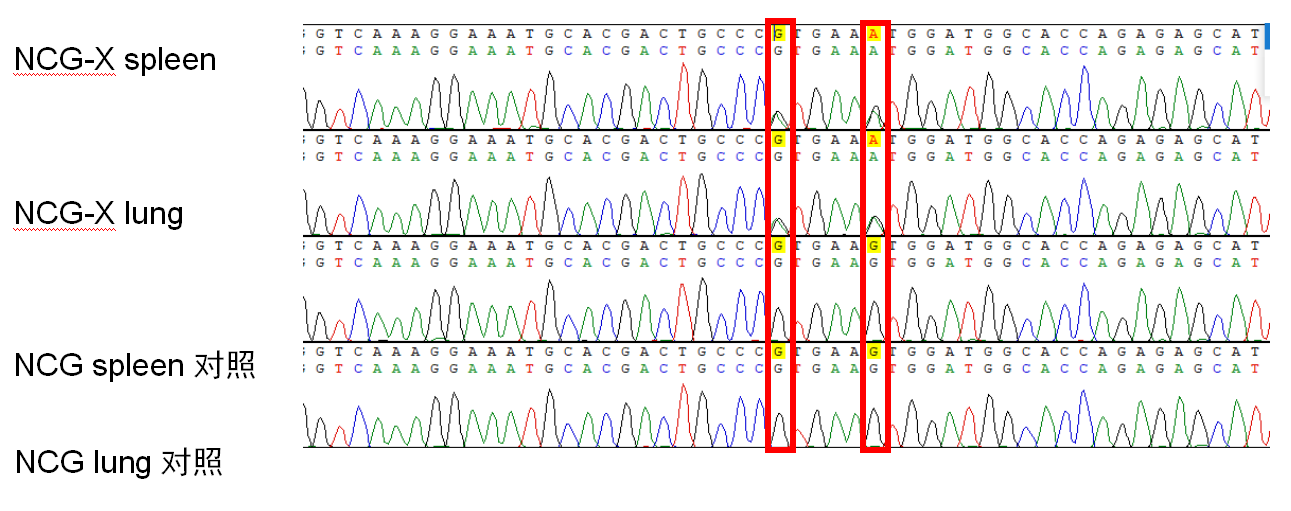
图1. NCG-X小鼠突变位点mRNA检测。
左侧红色框中为W41突变位点,右侧红框为引入的同义突变,NCG-X W41位点突变成功。
2. 脾脏免疫细胞分群检测
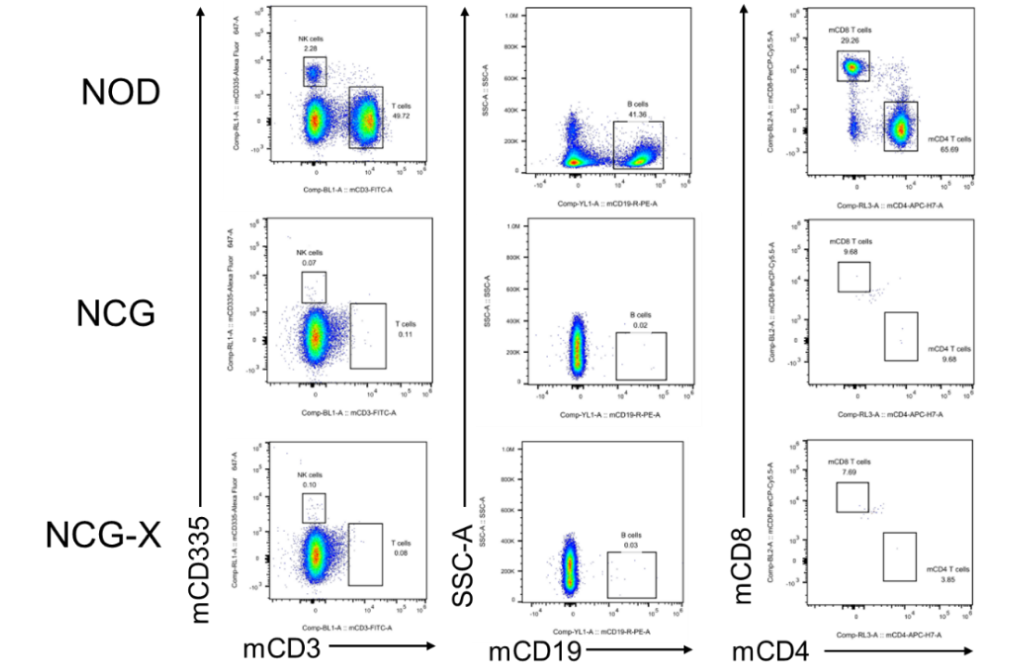
图2. NCG-X小鼠脾脏细胞比例检测
相较于NOD小鼠,NCG-X小鼠和NCG小鼠脾脏T/B/NK细胞缺失,NCG-X小鼠与NCG小鼠体内的T/B/NK细胞缺陷程度基本一致。
3. NCG-X小鼠骨髓细胞检测
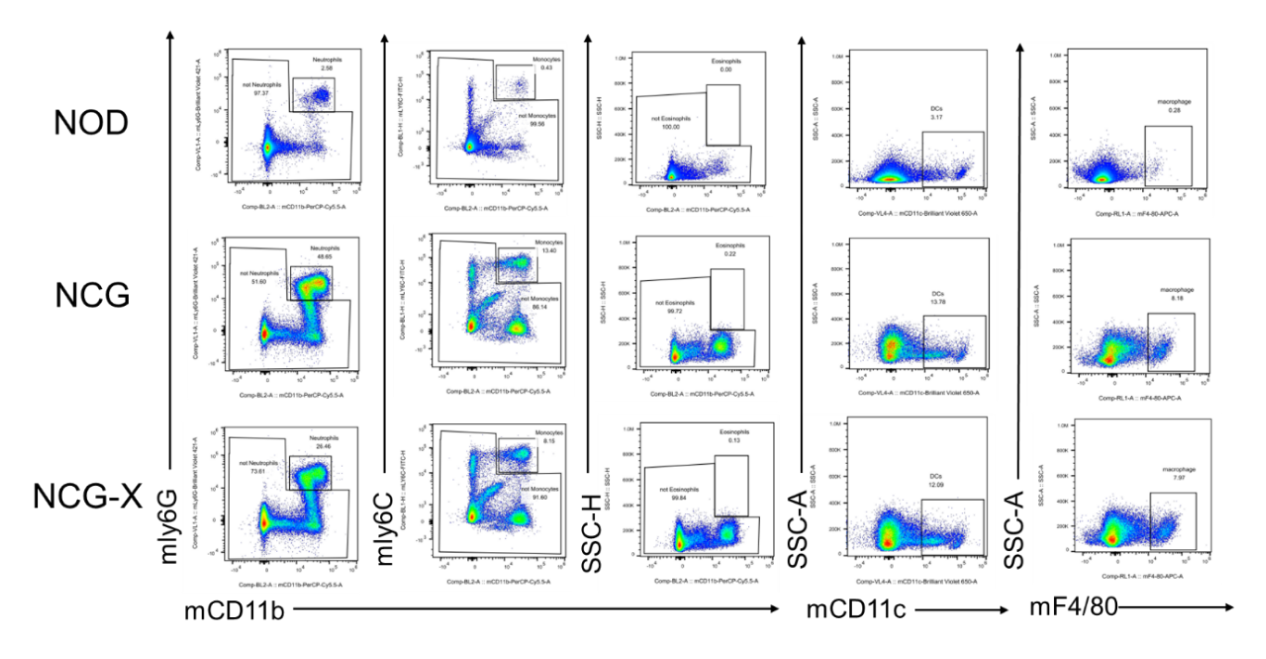
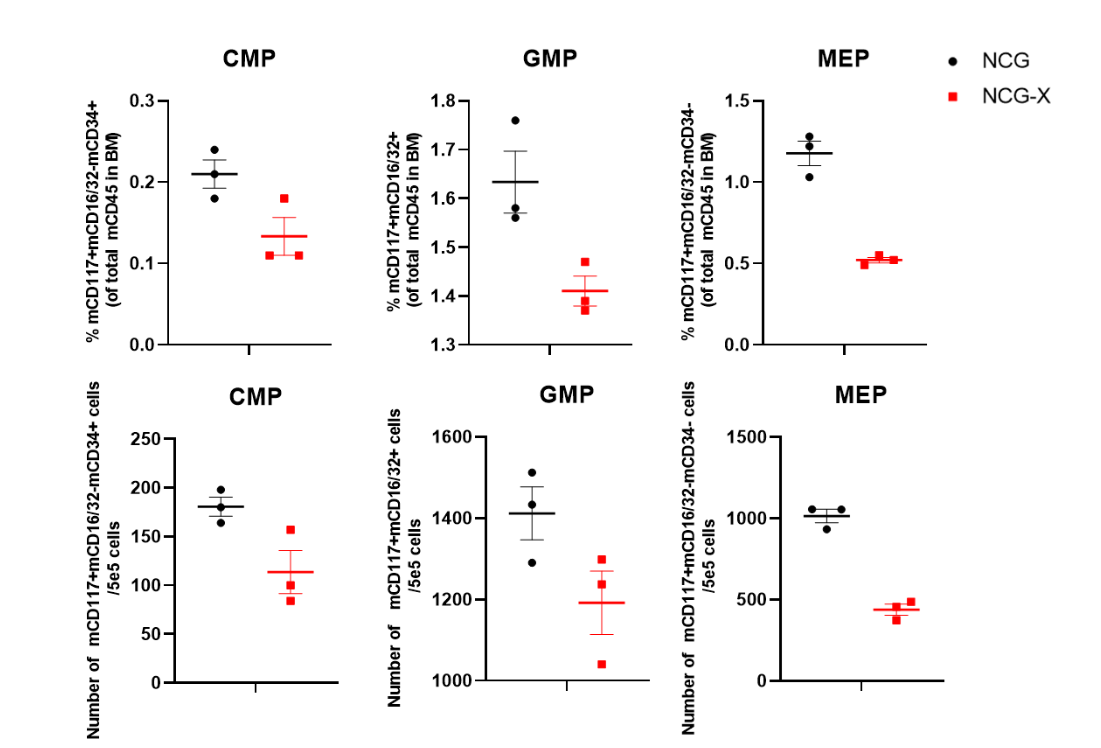
图3. NCG-X小鼠骨髓检测
NCG-X小鼠相较于NCG小鼠骨髓中CMP、GMP、MEP比例和数量下降。
4. 红细胞检测
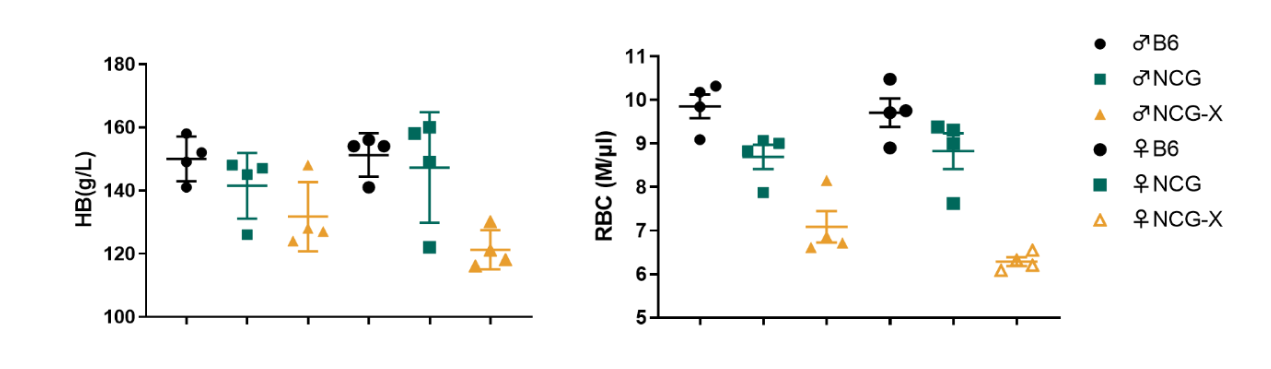
图4. NCG-X小鼠红细胞检测。
与B6,NCG小鼠相比,NCG-X小鼠红细胞及血红蛋白数量显著减少(8周龄小鼠)。
5. NCG-X小鼠体重和检测
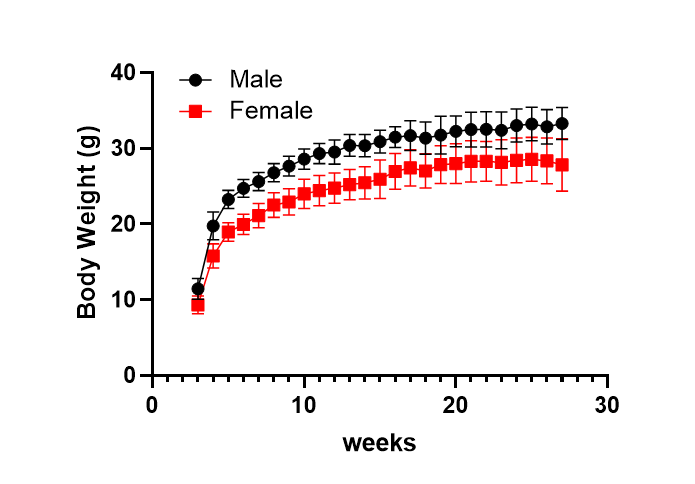
图5. NCG-X小鼠体重检测
NCG-X雄性小鼠比雌性小鼠体重增长更快。
6. NCG-X小鼠生存率检测
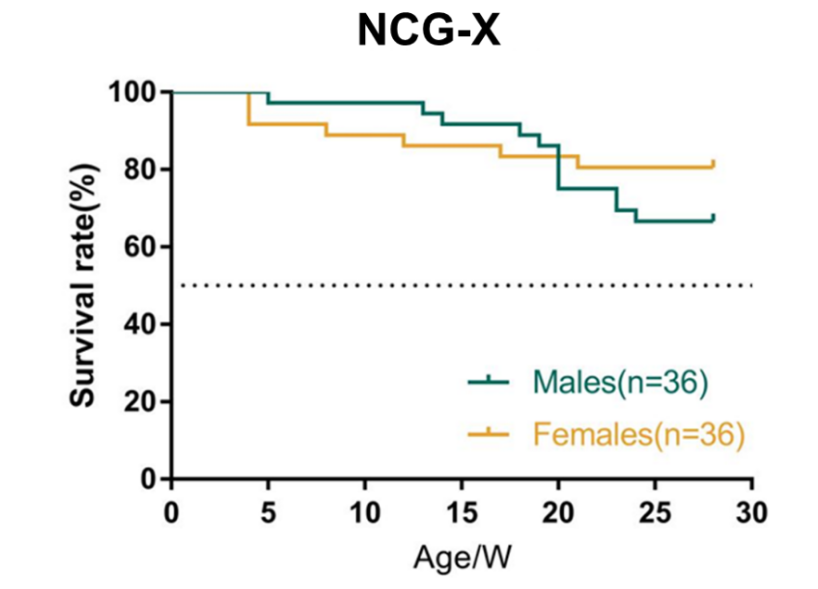
图6. NCG-X小鼠生存率
NCG-X雌性小鼠比雄性小鼠生存率更高,随着时间发生轻微的死亡。
7. huHSC-NCG-X小鼠外周血免疫重建水平
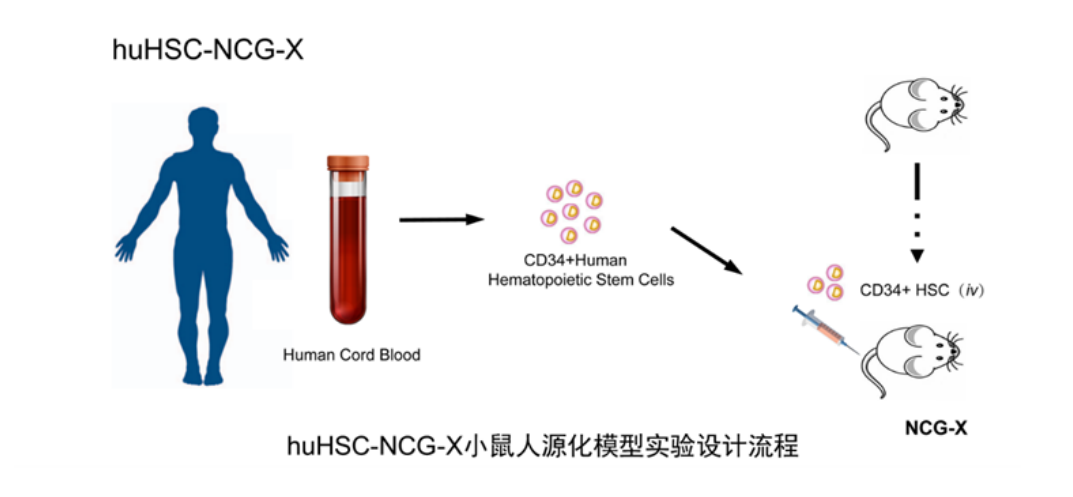
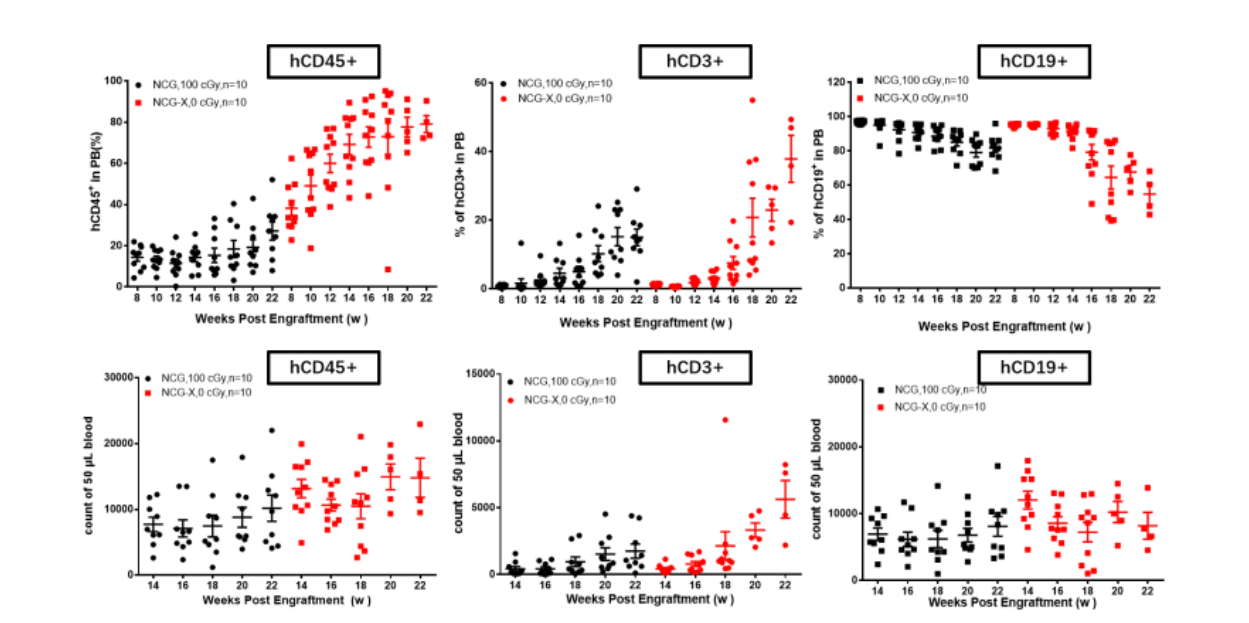
图7 NCG-X小鼠人HSC重建检测
NCG小鼠在进行人HSC重建检测时发现,NCG-X小鼠与辐照后的NCG小鼠相比,NCG-X小鼠不需要辐照即可高效重建人免疫系统,且hCD45+重建后比例增加。
8. huHSC-NCG-X小鼠骨髓红细胞及外周血红细胞重建
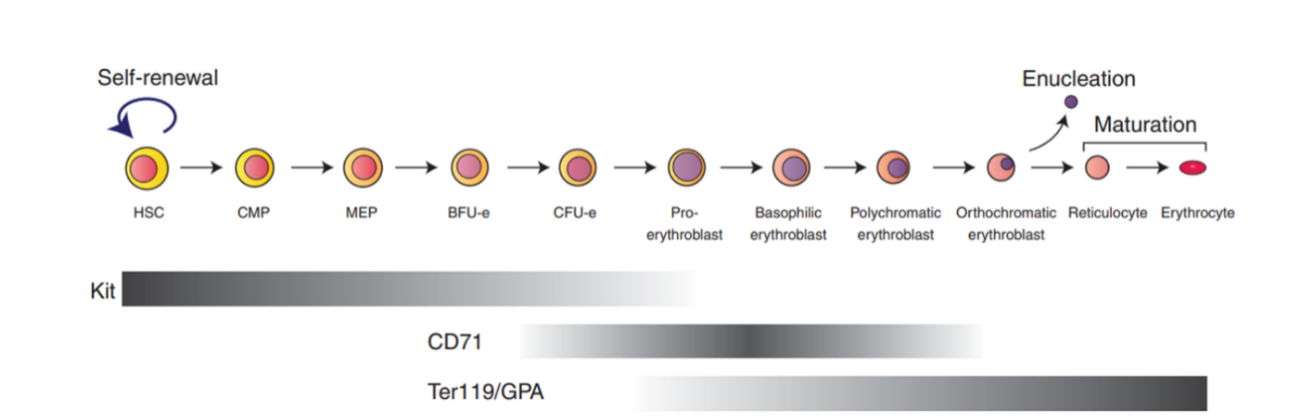
图8. 小鼠骨髓红系发育过程
红细胞成熟过程主要发生在骨髓内,首先是造血干细胞分化为髓系祖细胞(CMP)、接着分化为巨核-红系祖细胞(MEP)、红系爆式形成单位(BFU-e)、红系集落形成单位(CFU-e)、原幼红细胞、早幼红细胞、中幼红细胞、晚幼红细胞、网织红细胞、成熟红细胞。原始红细胞是有核细胞,在成熟过程中,其细胞核逐渐消失,细胞骨架发生改变逐渐形成双凹圆盘状的成熟红细胞并释放到外周血中。
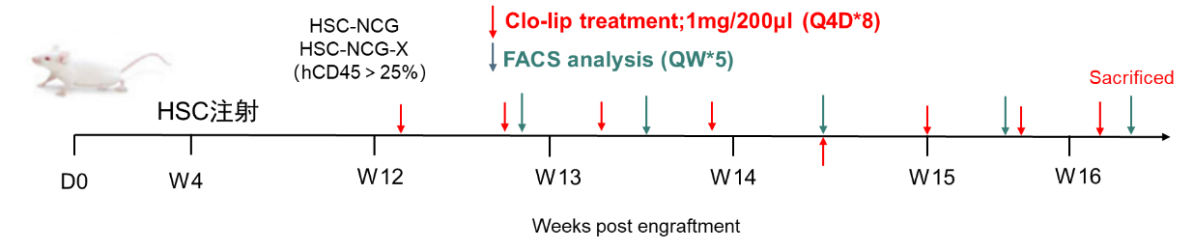
图9. 小鼠红细胞重建实验方案
选择两个不同供体来源的HSC CD34+分别移植到NCG,NCG-X小鼠中。重建后第十一周,采集小鼠外周血检测重建效率,根据huHSC-NCG,huHSC-NCG-X外周血hCD45重建效率及小鼠体重进行随机分组,第12周开始注射氯磷酸二钠脂质体(Clo-lip,40337ES10),第16周为实验终点。小鼠的巨噬细胞对人的红细胞具有吞噬作用,腹腔注射Clo-lip可清除小鼠外周血中的巨噬细胞,骨髓中发育的成熟红细胞进入外周血,从而在外周中重建出人的成熟红细胞。

图10. 小鼠巨噬细胞检测
给予Clo-lip后相较于PBS组,huHSC-NCG/NCG-X小鼠外周血鼠源巨噬细胞逐渐降低;收集小鼠脾脏组织,用mouse F4/80+抗体进行免疫组化分析,结果表明huHSC-NCG-X脾脏鼠源巨噬细胞的浸润减少。

图11. 小鼠人源成熟红细胞检测
给予Clo-lip后相较于PBS组,huHSC-NCG-X在外周血中重建的红细胞为成熟红细胞;收集小鼠脾脏和肝脏组织,用human CD235a+抗体进行免疫组化分析,结果表明huHSC-NCG-X脾脏有大量人源红细胞浸润,肝脏少量人源红细胞浸润。

图12. Clo-lip处理后小鼠体重和生存曲线图
Clo-lip处理后的huHSC-NCG-X小鼠死亡率有所上升且体重有所下降,可能跟红细胞重建效率增加及clo-lip的药物毒性导致的小鼠死亡率较高。
参考文献
Nocka, Karl, et al. "Molecular bases of dominant negative and loss of function mutations at the murine c-kit/white spotting locus: W37, Wv, W41 and W." The EMBO journal 9.6 (1990): 1805.
McIntosh, Brian E. et al. “Nonirradiated NOD,B6.SCID Il2rγ−/−KitW41/W41(NBSGW) Mice Support Multilineage Engraftment of Human Hematopoietic Cells.” Stem Cell Reports 4.2 (2015): 171–180. PMC. Web. 30 June 2017.
Waskow, Claudia, et al. "Hematopoietic stem cell transplantation without irradiation." Nature methods 6.4 (2009): 267-269.

